- Йога восьми кругов (Сидерский Андрей)
- Георгий Черданцев – о судьбе, профессии, семье
- Спастичность после инсульта
- Программа секции по волейболу Методическое обеспечение реализации программы
- Конор МакГрегор: биография бойца, профессиональная карьера и личная жизнь, интересные факты из жизни Стиль боя макгрегора
- Кому посвящает песни стас михайлов Инна канчельскис биография
- Тест "олимпийские игры древности"
- Анатомическая терминология
- Путь Емельяненко в куклы Не пора ли Последнему императору на покой?
- Аэробное и анаэробное дыхание
- Лечение артроза коленного сустава
- Личная жизнь и женщины павла мамаева
- Дыхание животом польза и вред
- Виталий Кличко: биография и досье на мэра Киева Кличко биография
- Правила присвоения спортивных разрядов в художественной гимнастике
- Конспект занятия по коррекции заикания у детей старшего дошкольного возраста «Зоопарк Конспект индивидуального занятия с заикающимися подростками
- «Конь не валялся» — значение и происхождение фразеологизма
- Российский биатлон отделался малой кровью
- Карьера в биатлоне, успехи
- Дмитрий Саутин (прыжки в воду): биография, личная жизнь, спортивные достижения, государственные награды
- Основные правила проведения соревнований по лыжному спорту
- Лечебная гимнастика при остеохондрозе шейного отдела позвоночника
- Уведомления Что нужно чтобы оформить паспорт болельщика
- Бассейн с минеральной водой почти в центре города
- Марта костюк - украинская чемпионка, покорившая австралию
- Охотники на привале (страшные истории) Джидинский снежный человек
- Белье для похудения с эффектом сауны – пожалуй, лучший способ сбросить вес Одежда для тренировок для похудения
- Жест и поза в художественной гимнастике
- Массаж бедер: анатомия, техники, виды воздействия
- Туристско-спортивный союз россии
- Каким должен быть зимний велосипед
- Катя Гамова: биография, рост, фото, родители, муж Рост гамовой екатерины и ее муж
- Положение «О порядке регистрации переходов из одной физкультурно-спортивной организации в другую, от тренера к тренеру и принадлежности спортсменов, являющихся кандидатами в спортивную сборную команду Российской Федерации по настольному теннису»
- Веселые физминутки в стихах и картинках Мед
- Подвернул лодыжку и нога опухла в голеностопе: как вылечить народными средствами
- В какой группе играет Россия
- Неизвестные факты о трагедии магомеда абдусаламова Магомед абдусаламов бой с майком пересом
- Гимнастика при остеохондрозе грудного отдела позвоночника
- Андрей платонов - умная внучка
- Олег блохин - биография, информация, личная жизнь
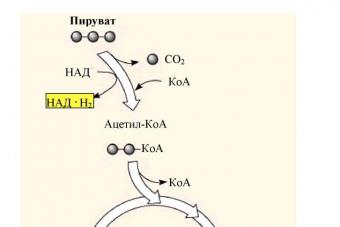
Аэробное и анаэробное дыхание
Клеточное дыхание - это окисление органических веществ в клетке, в результате которого синтезируются молекулы АТФ. Исходным сырьем...